研究背景
随着影像诊断技术的革新、外科手术的进步、靶向及免疫药物的使用等,肝细胞肝癌(Hepatocellular Carcinoma, HCC)患者的整体生存期有了较大的改善,但5年生存期仍较低,其原因之一是患者就诊时就已出现微血管侵犯(Microvessle Invation, MVI)。MVI是指肿瘤对微血管的侵犯,在显微镜下表现为在内皮细胞衬覆的血管腔内见到癌细胞巢团,常见于癌旁肝组织内的门静脉小分支和肝静脉分支,如图 1所示。MVI的发生率在15%~57.1%之间,它的出现提示了HCC的生物学行为更具侵袭性,因此是影响肝癌预后的重要因素,也是治疗方案制定的重要参考依据。近年来,大量的研究试图采用CT、MRI等影像方法结合临床及实验室指标对MVI进行术前预测,这有助于指导肝癌患者治疗决策。
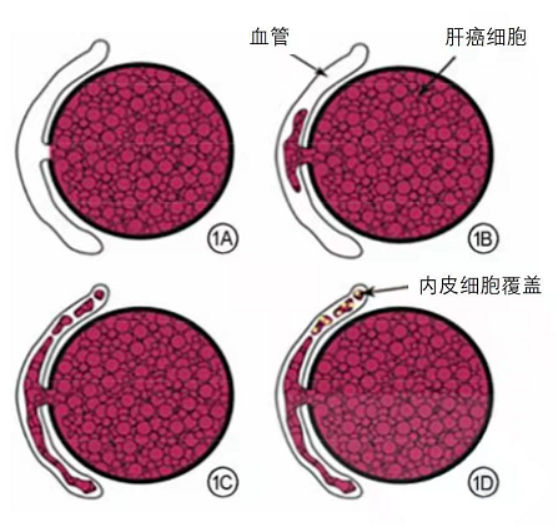
图 1 肝细胞癌的微血管侵犯过程表现
南京信息工程大学-中大医院智慧医疗研究院自2021年成立以来便一直致力于通过医学影像和病理切片等医学数据对癌症进行病灶区域分割、病种预测以及生存预后等研究。近期,该团队基于术前配准后四期CT影像,提出一个新颖的、通过构建影像组学模型预测MVI情况的方法,并揭示了MVI潜在的生物学机制。此外,该方法也可以灵活的运用于其他配准后的多模态数据的研究。该研究成果(Predicting Microvascular Invasion in Hepatocellular Carcinoma using CT-based Radiomics Model)已在线出版于Radiology(IF = 29.15)。
1. 简介
先前的研究表明,各种临床和放射学特征——如血清甲胎蛋白(Alpha-fetoprotein)、肿瘤大小和静脉侵犯的双特征预测因子(TTPVI)——是MVI的独立预测因子。影像学检查,尤其是CT检查,对于HCC的常规诊断和评估至关重要。放射组学是一种新兴的成像分析形式,可用于以高通量的方式获取有用的信息,其有潜力将数字医学图像转化为无数揭示病理生理学的定量特征。最近,有报道称放射组学模型可以基于CT图像准确预测MVI。到目前为止,MVI的术前预测还是具有挑战性,因为MVI是一种组织病理学发现,只能通过术后手术标本进行诊断。
为了缓解上述挑战,本研究首先建立和测试了一个基于肝细胞癌患者多期CT放射组学特征预测微血管侵袭(MVI)的模型。然后,开展一项初步研究,最终确定了MVI相关的差异表达基因。该研究的主要贡献总结如下:
• 开发了一个新的影像组学方法,通过图像配准、减影的方法构建了Delta影像组学特征,成功将CT图像增强的变化量化并加入了模型,发现模型的性能提高,并且模型能够对患者预后分层。
• 在转录组水平,发现在MVI阳性组中,MVI相关差异表达基因(由图像特征得出)参与了更多的葡萄糖代谢,而肿瘤内的免疫细胞浸润则减少。
2. 方法
图2是本研究影像组学研究流程,大体可以概括为以下五点:
l 通过深度学习算法和Elastix对肝脏区域进行配准(以门静脉期为固定图像)。
l 在配准图中手动勾画3D肿瘤感兴趣区(VOI),并通过算法向外扩展5mm作为瘤周区域(擦除非肝脏实质组织);通过配准图像生成减影图像。
l 提取影像组学特征,对不同期相的组学特征做差值,生成Delta1影像组学特征;对减影图像提取特征定义为Delta2影像组学特征。
l 采取的建模策略是采用ICC评估特征稳定性、mRMR和LASSO来对特征进行降维,最后主要用Logistic回归来构建模型。
l 在队列1-3中建立和测试影像组学模型和混合模型,在队列4中验证模型对于预后的分层能力,在队列5中探索MVI的潜在生物学机制。
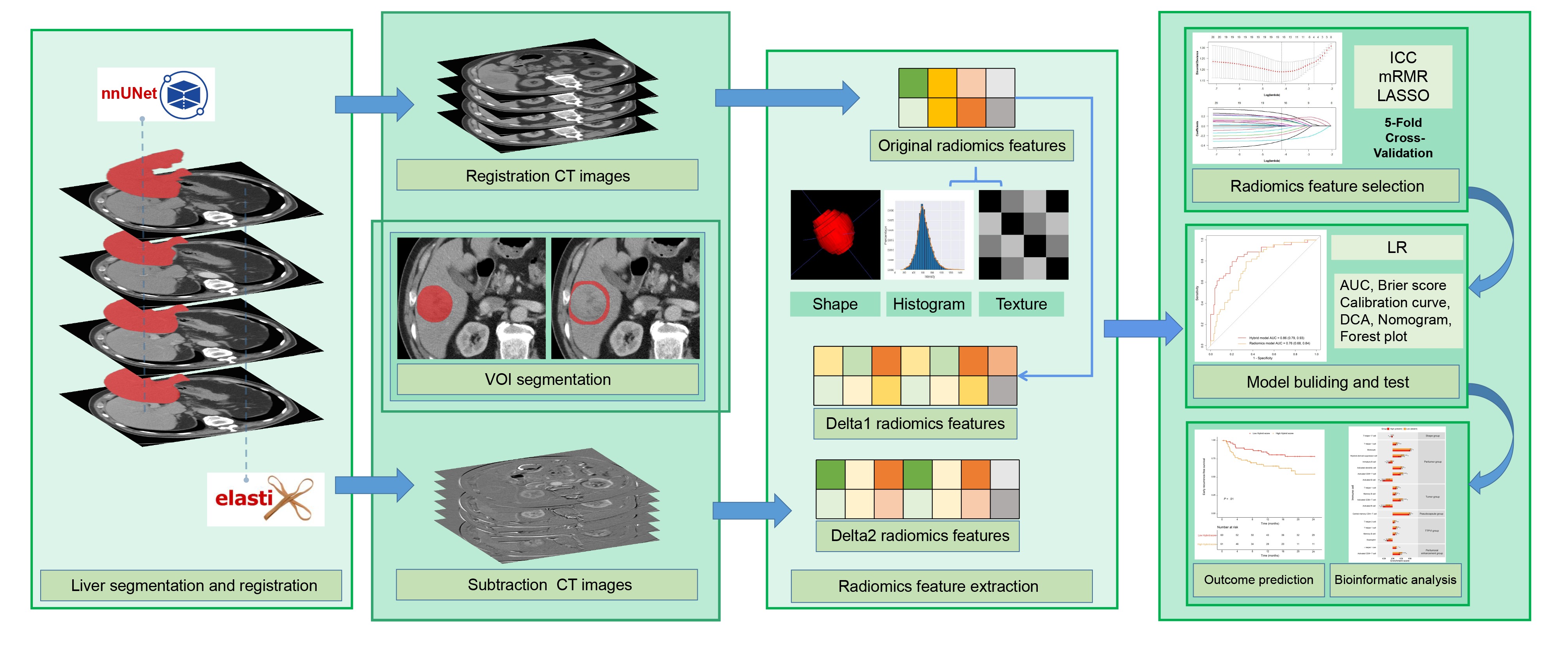
图 2 影像组学流程图
3.实验及结果
本研究从四家医疗中心和TCIA数据库,回顾性纳入了773例经手术病理确诊为HCC患者的术前影像及临床资料。将中心1按7:3划分为训练队列(n=334)和内部测试队列(n=142),中心2-3合并为外部测试队列(n=141),中心4为预后队列(n=121),中心5为TCIA队列(n=35)。MVI通过手术病理证实,中心1-3有MVI标签,中心4-5无MVI标签,中心4有早期无复发生存期和总生存期数据,中心5有RNA测序数据。表1描述了数据集及其影像特征的样本分布。
Characteristics |
Training set (n = 334) |
Internal test set (n = 142) |
External test set (n = 141) |
Outcome cohort (n = 121) |
TCIA set (n = 35) |
Patient demographics |
|
|
|
|
|
Age (years)* |
59 (51-66) |
57 (49-64) |
55 (49-63) |
53 (46-59) |
65 (56-70) |
Sex (male) |
287 (85.9%) |
120 (84.5%) |
111 (78.7%) |
95 (78.5%) |
20 (64.5%) |
HBV infection |
254 (76.0%) |
109 (76.8%) |
115 (81.6%) |
90 (74.4%) |
18 (51.4%) |
BCLC stage (0 or A) |
324 (97.0%) |
139 (97.9%) |
136 (96.5%) |
118 (97.5%) |
31 (88.6%) |
Liver cirrhosis |
215 (64.4%) |
87 (61.3%) |
112 (79.4%) |
67 (55.4%) |
N/A |
Clinical parameters |
|
|
|
|
|
Child-Pugh grade (A) |
322 (96.4%) |
136 (95.8%) |
138 (97.9%) |
111 (91.7%) |
22 (71.0%) |
AFP (ng/mL) * |
22.1 (4.5-236.7) |
13.4 (3.6-217.5) |
41.1 (4.7-448.9) |
25.4 (5.0-246.0) |
10.0 (3.0-116.5) |
ALT (U/L) * |
28 (23-38) |
26 (17-35) |
33 (24-44) |
34 (24-50) |
N/A |
AST (U/L) * |
28 (23-38) |
26 (22-33) |
34 (24-48) |
35 (25-52) |
N/A |
Radiological features |
|
|
|
|
|
Max tumor diameter (cm) * |
3.5 (2.2-5.0) |
3.4 (2.2-5.0) |
3.5 (2.2-6.0) |
5.3 (3.8-8.0) |
6.9 (3.9-11.3) |
Tumor number (solitary) |
316 (94.6%) |
134 (94.4%) |
136 (96.5%) |
118 (97.5%) |
31 (88.6%) |
Pseudocapsule (ill-defined) |
123 (36.8%) |
50 (35.2%) |
39 (27.7%) |
44 (36.4%) |
10 (28.6%) |
TTPVI (present) |
81 (24.3%) |
34 (23.9%) |
37 (26.2%) |
39 (32.2%) |
9 (25.7%) |
Peritumoral enhancement (present) |
55 (16.5%) |
20 (14.1%) |
22 (15.6%) |
31 (25.6%) |
7 (20.0%) |
Margin (non-smooth) |
148 (44.3%) |
46 (32.4%) |
67 (47.5%) |
62 (51.2%) |
17 (48.6%) |
MVI (present) |
120 (35.9%) |
44 (31.0%) |
54 (38.3%) |
N/A |
N/A |
表 1患者的基础特征
表2展示了对训练集MVI病人相关变量的Logistic回归分析,可以看出假包膜、TTPVI、瘤周强化以及影像组学分数是预测MVI的独立危险因素(p<0.01)。
Characteristics |
Univariable analysis |
Multivariable analysis |
OR (95% CI) |
P value |
OR (95% CI) |
P value |
Age, ≤50 vs >50 years |
0.63 (0.38, 1.05) |
.08 |
|
|
Sex, male vs female |
1.23 (0.64, 2.38) |
.54 |
|
|
HBV infection, absent vs present |
1.06 (0.62, 1.78) |
.84 |
|
|
BCLC stage, 0 or A vs B |
1.82 (0.52, 6.41) |
.35 |
|
|
Liver cirrhosis, absent vs present |
0.99 (0.62, 1.57) |
.95 |
|
|
Child-Pugh grade, a vs b |
2.59 (0.80, 8.35) |
.099 |
|
|
AFP, ≤ 200 vs > 200 ng/mL |
2.19 (1.34, 3.59) |
.002 |
|
|
ALT, ≤ 50 vs > 50 U/L |
1.30 (0.72, 2.34) |
.38 |
|
|
AST, ≤ 40 vs > 40 U/L |
1.62 (0.96, 2.73) |
.07 |
|
|
Max tumor diameter, ≤ 5 vs > 5 cm |
3.18 (1.86, 5.46) |
< .001 |
|
|
Tumor number, solitary vs multiple |
1.46 (0.56, 3.80) |
.44 |
|
|
Pseudocapsule, well-defined vs ill-defined |
2.40 (1.51, 3.81) |
< .001 |
4.50 (2.45-8.28) |
< .001 |
TTPVI, absent vs present |
8.44 (4.78, 14.90) |
< .001 |
6.78 (3.39-13.54) |
< .001 |
Peritumoral enhancement, absent vs present |
5.96 (3.15, 11.26) |
< .001 |
3.20 (1.50-6.84) |
< .001 |
Margin, smooth vs non-smooth |
0.80 (0.51, 1.26) |
.34 |
|
|
Radiomics score (continuous) |
2.73 (2.09, 3.56) |
< .001 |
2.23 (1.65-3.02) |
< .001 |
表 2 训练集中的临床和影像特征
表3展示了用所有影像组学特征建立的模型Radiomics model及在其基础上加入了临床、影像特征而建立的Hybrid model在训练集、内部测试集和外部测试集上的性能。可见融合了前述的4个影像学特征,混合模型的效能又得到了进一步提高。
Model and Metric |
Radiomics model |
Hybrid model# |
P value |
Training set (n = 334) |
|
|
|
Sensitivity |
71 (85/120) |
83 (100/120) |
.001 |
Specificity |
71 (153/214) |
78 (167/214) |
.08 |
Accuracy |
71 (238/334) |
80 (267/334) |
.001 |
AUC* |
0.76 (0.71, 0.82) |
0.85 (0.81, 0.89) |
< .001 |
Internal test set (n = 142) |
|
|
|
Sensitivity |
80 (35/44) |
80 (35/44) |
> .99 |
Specificity |
66 (65/98) |
80 (78/98) |
< .001 |
Accuracy |
70 (100/142) |
80 (113/142) |
.007 |
AUC* |
0.76 (0.68, 0.84) |
0.86 (0.79, 0.93) |
.002 |
External test set (n = 141) |
|
|
|
Sensitivity |
65 (35/54) |
74 (40/54) |
.27 |
Specificity |
74 (64/87) |
85 (74/87) |
.04 |
Accuracy |
70 (99/141) |
81 (114/141) |
.01 |
AUC* |
0.72 (0.63, 0.81) |
0.84 (0.78, 0.91) |
< .001 |
表3 混合和放射组学模型的诊断性能
在预后队列中,根据影像组学模型(最优)和混合模型得到的患者MVI预测得分,都能对肝癌患者的早期复发生存期(2年内的复发)以及总生存期进行风险分层,如图3。其中,(A, B) 1年和2年无复发生存期和(C, D) 1年、3年和5年总生存期采用放射组学模型衍生评分和混合模型衍生评分进行评估。低模型分数用红线表示,高模型分数用黄线表示。
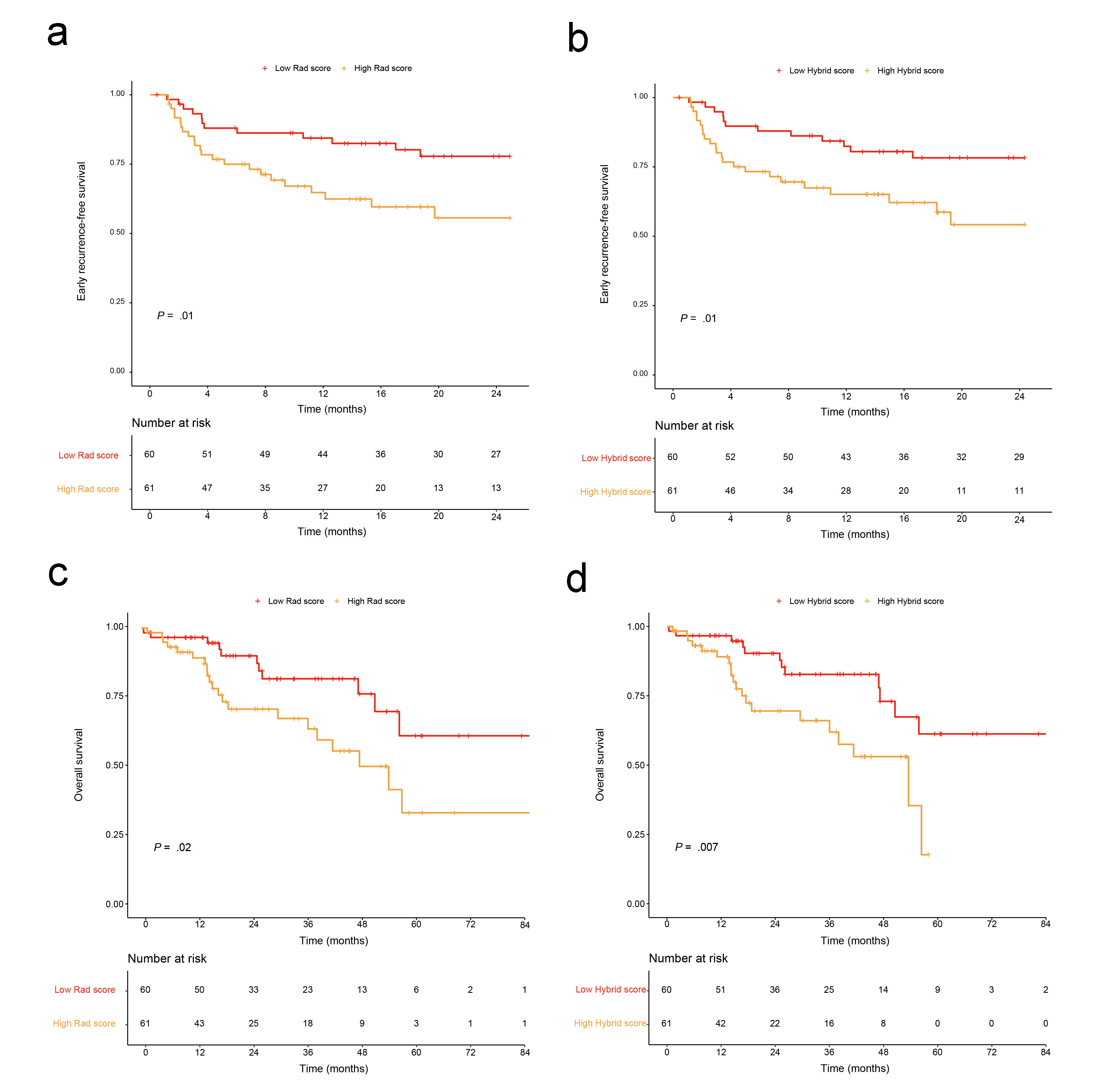
图 3 生存曲线
图4展示了在TCIA队列中,根据MVI相关的影像学特征,我们筛选出相关的MVI差异基因。对这些MVI相关差异基因做富集分析,发现糖代谢等相关通路在MVI高风险组富集,尤其是糖酵解和戊糖磷酸化途径。此外,根据MVI相关的影像学特征分组探索免疫细胞在各个分组中的表达水平,探讨免疫浸润和MVI的相关性,发现在多种免疫细胞中,MVI高危组的免疫浸润水平要低于MVI低危组,尤其是CD8+ T细胞。
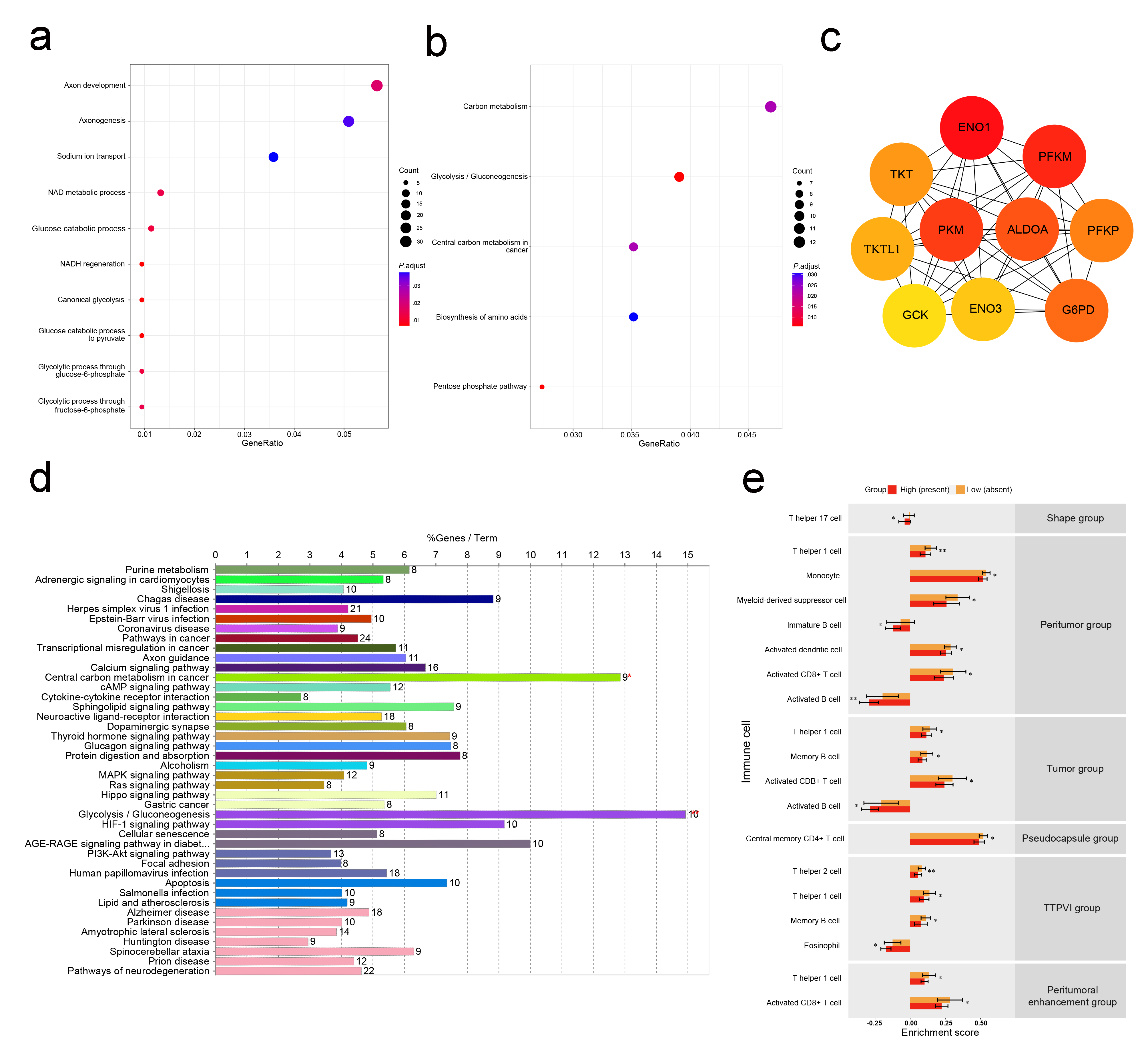
图 4 相关基因的筛选
通过图5可以看出混合模型成功地预测了两例患者的MVI状态。(a-b)57岁男性患者,MVI阴性,CT显示一9.5厘米的肿瘤,无TTPVI(黑白箭头),瘤周增强,有明确的假包膜(红色箭头)。免疫组化显示瘤内有丰富的CD8+ T细胞浸润。术后患者至目前无复发,已存活82.3个月。(c-d)35岁男性患者,MVI阳性,CT显示一10.9厘米肿瘤。肿瘤表现为瘤周强化(黄色箭头),TTPVI和界限不清的假包膜。免疫组化显示肿瘤内部CD8+ T细胞稀少。该患者术后3.4个月复发,13.5个月死亡。
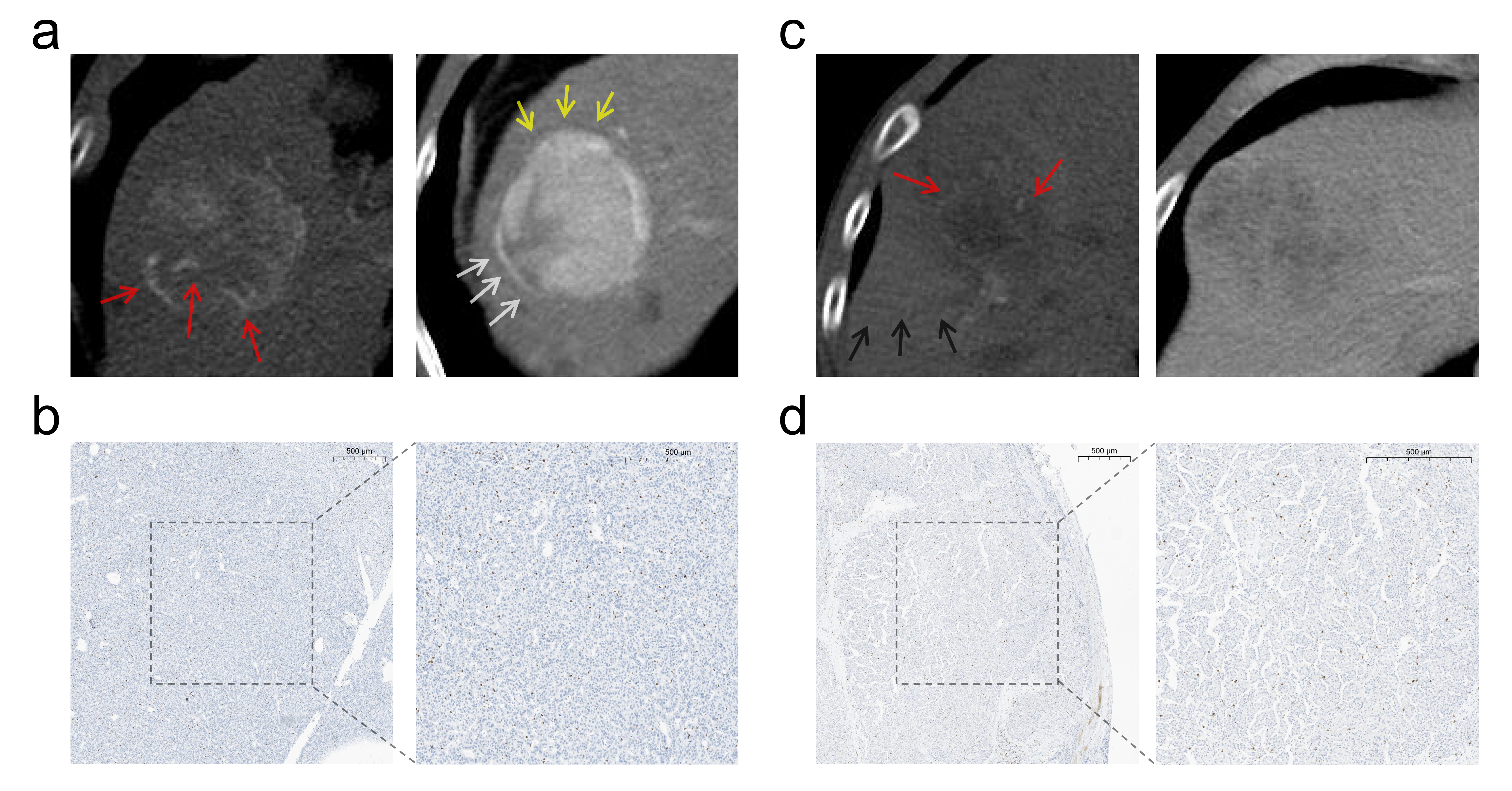
图 5 两例HCC患者的CT影像及CD8+T细胞免疫组化
总结
为了缓解预测HCC患者的MVI情况的困难和挑战,本研究结合CT放射学和放射组学特征构建的Hybrid模型能够成功预测肝细胞癌患者的微血管浸润(MVI)状态。我们还发现MVI相关差异表达基因通常参与葡萄糖代谢。需要进一步的研究来确保我们的模型的可泛化性,并测试我们的转录组测序结果在细胞或动物实验中的生物学相关性。
随着先进的医学图像分析工具发展,我们可以更容易地从影像和组织病理学切片中提取疾病的多尺度图像生物标志物,例如毫米级和微米级图像表型。这些多尺度图像生物标志物可以帮助医生从影像学和组织学图像中更准确地检测和诊断疾病,并尝试预测复发风险、疾病侵袭性、患者生存率以及患者对治疗的反应。智慧医疗研究院长期以来致力于探索先进的机器学习驱动的影像学和组织学图像分析方法,通过对影像图像和数字化组织样本的“图像生物标记物”的提取和分析,以辅助医生改善疾病的预防、诊断和预后以及更好地评估患者对治疗的响应。
智慧医疗研究院的研究队伍来自医学和工程学等不同学科的专家和学生团队,他们利用各自专业的知识,共同解决医疗领域的难题。医工交叉队伍的优势在于能够整合多方面的资源和视角,创新医疗技术和方法,提高医疗质量和效率,促进医疗事业的发展。本论文是南京信息工程大学徐军教授所领导的工学团队以及中大医院居胜红教授所领导的医学团队长期合作,共同努力致力于医学与工程技术等学科相结合,解决生命健康领域重大问题的一项研究成果。研究院通过医工交叉研究,促进医学和生命科学的基础研究和应用研究,从而提高医生对疾病的诊断和治疗水平和效率,为人类健康和福祉做出贡献。同时,通过医工交叉研究也可以激发理工科学家和医学科学家之间的合作和交流,拓展各自的知识视野和思维方式,培养具有跨学科能力和创新精神的人才,为科技进步和社会发展提供动力。