北卡罗来纳大学教堂山分校(UNC-Chapel Hill)IDEA实验室(https://www.med.unc.edu/bric/ideagroup/core-labs/idea-research-lab/)在医疗AI的顶级会议MICCAI-2019上录取了27篇论文。这些论文的研究主题可归纳为:图像合成,婴幼儿脑发育,老年痴呆症、抑郁症及癫痫,牙齿正畸,基因与病理,人脑微结构组织等。下面对这些研究主题和27篇论文作一一介绍,希望对大家的研究有所启发。
老年痴呆症、抑郁症及癫痫
17. Zhou et al.,“Inter-modality Dependence Induced Data Recovery for MCI Conversion Prediction”.
轻度认知功能障碍(Mild Cognitive Impairment, MCI)被认为是老年性痴呆(Alzheimer's Disease,AD)的早期阶段。鉴于AD患者的不可逆的病理过程,研究和识别稳定型MCI(sMCI)和进展型MCI(pMCI)具有重要的临床价值。许多研究表明融合多模态信息(例如MRI和PET)能提高识别精度,但如何解决常见的模态缺失问题仍然是一个挑战。Zhou等人[17]提出了一种新颖的融合缺失模态数据补全、多模态隐表示学习、预测模型学习于一体的MCI预测模型(参见图19)。该方法的主要优势是利用数据类别信息来指导缺失数据的补全,以及学习多模态的隐表示来降低模态间的差异性。实验结果展示了该方法在预测MCI向AD转化的有效性(参见图20)。

图19:新颖的将缺失样本补全、隐表示学习和预测模型融于一体的模型。

图20:不同方法所得到的MCI转化预测结果。
18. Lian et al.,“End-to-End Dementia Status Prediction from Brain MRI using Multi-Task Weakly-Supervised Attention Network”.
临床实践证明认知测试(如简明精神状态量表MMSE,临床痴呆评分总和CDR等)的量化结果往往与阿尔兹海默症(AD)的病程进展联系紧密。根据前期大脑结构磁共振(sMRI)图像自动预测临床评分结果(Clinical Scores)对衡量和预测AD的病程有重要意义。Lian等人[18]提出了一种端到端的深度神经网络模型(MWAN),高效准确地完成多个认知测试结果的同时预测(图21)。区别于传统的机器学习和深度学习模型,MWAN 采用可训练的弱监督注意力机制(Weakly-supervised Attention Module)从全脑 sMRI图像中自动定位个体特异的(Subject-specific)病变区域,并以此为基础提取高阶图像特征并构建多任务回归模型。该文采用2-fold交叉验证,在多个公开数据集上进行了验证。实验结果表明,该文提出的MWAN模型能够精确地自动定位病变区域,并取得了优于现有深度学习方法的预测结果。

图21:提出的MWAN网络,用于基于全脑MRI图像的端到端大脑病变区域自动定位及多目标AD病程预测。
19. Jiao et al.,“Dynamic Routing Capsule Networks for Mild Cognitive Impairment Diagnosis”.
阿尔茨海默病(AD)是一种慢性神经退行性疾病,会给患者带来极大的痛苦。在轻度认知障碍(MCI)的早期阶段如能及时诊断则可能有效减缓AD的发展并减轻患者痛苦。Jiao等人[19]提出了一种新颖的用于MCI诊断的动态胶囊神经网络(dynamic CapsNet),并提出和讨论了两种Dynamic CapsNet的变体,这两种方法可分别动态表示Intra-ROI(图22)和Inter-ROI的静息态功能磁共振活动(图23)。此外,该文在Inter-ROI动态表示模型中采用了可学习的动态“神经元连接”,在Dynamic CapsNet的训练期间,不同人工神经元之间的连接可以动态学习。该工作也是第一次用端到端学习的CapsNet进行MCI诊断(图24)。该文所提出的Intra-ROI / Inter-ROI CapsNet的分类精确度为0.729(0.023) / 0.773(0.022),灵敏度为0.799(0.042) / 0.771(0.027),特异度为0.673(0.065) / 0.774(0.040)。

图22:所提出的Intra-ROI Dynamic CapsNet方法结构图。

图23:所提出的Inter-ROI Dynamic CapsNet方法结构图。

图24:与其他方法相比的ROC和AUC 。
20. Zhou et al.,“Deep Multi-modal Latent Representation Learning for Automated Dementia Diagnosis”.
阿尔茨海默病(AD)是一种严重且多发的老年退行性疾病。由于老年人占人口总数的比例逐渐增大,AD的发病率也在不断增加,因此AD的早期诊断和预测尤为重要。许多现有方法均采用融合多模态数据(例如MRI和PET)来提高诊断精度,但仍然面临一些挑战。首先,多模态数据融合和基于多模态数据的诊断模型学习往往被分开执行,这忽略了它们之间的相关性;其次,如何有效地融合多模态数据并降低数据间的冗余信息并提高分类精度仍非常困难。Zhou等人[20]提出了一种新的融合多模态融合、深度隐表示学习和预测模型学习于一体的疾病诊断方法。该方法基于深度矩阵分解来提取每个模态的高阶(High-level)特征,并使得多模态数据共享这些高阶特征来深度挖掘多模态图像之间的相关性。在ADNI数据集上的实验结果验证了该文提出算法的有效性(参见图25)。

图25:不同方法的对比结果 (NC:Normal Control;MCI:Mild Cognitive Impairment;pMCI:progressive MCI;sMCI:stable MCI)。
21. Li et al.,“Identification of Abnormal Circuit Dynamics in Major Depressive Disorder via Multiscale Neural Modeling of Resting-state fMRI”.
传统的静息态功能磁共振集中研究不同脑区之间的功能同步性。这一方法的最大弱点是无法提供大脑认知功能在神经回路层面的机制性理解。为了突破这一局限,Li等人[21]将计算神经科学与传统连接组学结合在一起建立了多尺度神经模型参数估计方法(图26)。这一方法的最大优点是可以将微观神经回路的相互作用与宏观网络的动态变化有机整合,并且可以估算脑区内部以及脑区之间的多尺度有向连接的强度。该文把这一方法应用到66个初次发病尚未用药的抑郁症病人和66个健康对照的静息态功能磁共振数据,并对大脑的多个高级认知网络进行建模。研究发现抑郁症病人的背外侧前额叶皮质内部的兴奋性和抑制性连接强度比正常组降低,同时丘脑内部的兴奋性连接强度比正常组异常增高。这些发现与已知的这两个脑区在抑郁症中的功能异常相一致。这一新方法为精神疾病的神经病理机制研究提供了一种新的途径。

图26:用于研究抑郁症神经病理(Pathophysiological Mechanisms)的多尺度(Multiscale)神经模型参数估计方法。
牙齿正畸
22. Lian et al.,“MeshSNet: Deep Multi-Scale Mesh Feature Learning for End-to-End Tooth Labeling on 3D Dental Surfaces”.
作为矫正治疗计划(Orthodontic Treatment Planning)的关键环节,从三维牙科表面模型(Dental Surface Model)上精确标注牙齿是分析和重排牙齿位置的前提。先进的口腔内扫描仪(IntraOral Scanner,IOS)虽然实现了高效的三维表面模型重构,但由于IOS采集数据的不规则性,牙齿标注仍具有挑战性。Lian等人[22]提出一种端到端的深度学习模型(即MeshSNet)从原始的3D网格表面(Surface Mesh)上自动学习高阶表面特征,从而实现了高效且精确地自动标注牙齿。区别于传统的CNN模型,该文提出的MeshSNet模型直接以网格表面元素(Mesh Triangle)的基本特征为(即Triangle顶点坐标和法向量)输入,并模拟CNN的机制以分层地学习和融合多尺度高阶特征以提高标注的准确性(图27)。该文采用3-fold交叉验证在真实的IOS牙科表面数据上进行测试,结果表明MeshSNet性能优异(平均Dice>0.93)。

图27:提出的MeshSNet模型,其从原始的3D网格表面数据上学习和融合多尺度高阶几何特征,以实现端到端的牙齿自动标注。
23. Xiao et al.,“Estimating Reference Bony Shape Model for Personalized Surgical Reconstruction of Posttraumatic Facial Defects”.
额面矫正手术中,需术前估计病人正常的面部骨骼形状用于术前规划。Xiao等人[23]针对因事故(如车祸,战争等)造成的面部缺损,提出了一种自动化病人正常面部骨骼形状预测方法。该方法利用病人事故前拍摄的人脸照片及当前病人头部CT影像,并结合三维人脸重建、稀疏表示、统计形状模型及形变建模等技术,精确且快速地恢复病人正常面部骨骼形状(图28)。相对于传统依靠医生经验手工构建正常骨骼的方法,该方法不但提高了预测的精度及效率,同时也优化了此类额面矫正手术的术前规划实施流程。

图28:额面骨骼重建流程图,大致分为三个阶段:1)从患者过往二维人脸照片中重建正常三维人脸;2)由正常人脸CT数据集(术前收集)中分别提取人脸皮肤和骨骼,并构造一个关联二者的关联模型,然后将重建的三维人脸导入关联模型估计患者正常额面骨骼的初始形状;3)结合一个形状形变模型在当前患者面部骨骼形状的基础上优化初始估计、获得最终的正常额面骨骼形状模型。
基因与病理研究
24. Tang et al.,“Pre-operative Overall Survival Time Prediction for Glioblastoma Patients Using Deep Learning on Both Imaging Phenotype and Genotype”.
研究证明胶质母细胞瘤(GBM)患者预后与肿瘤的分子病理指标有着十分紧密的联系。目前GBM预后研究主要基于术前预测,而术前无法得知肿瘤分子病理信息,因此无法利用该信息提高预后精度。Tang等人[24]提出了一种多任务的深度学习框架,从术前多模态脑影像数据中提取与肿瘤分子病理相关的特征,并将其用于分子病理分型预测和全因生存期(Overall Survival)预测中,通过同时提取分子病理相关的特征来提高预后的预测精度。该文使用合作医院临床采集的120名GBM患者的多模态脑影像(T1增强和弥散加权成像DWI),采用十折交叉验证,与现有预后预测方法相比,该方法在全因生存期预测任务中达到了比传统方法更高的精度(图29)。

图29: 该方法预测的120例GBM患者全因生存期所构造的生存曲线。与基于单任务CNN和放射组学方法(RD-RF)得到的曲线相比,该方法的预测结果更贴合真实的生存曲线。
25. Zhu et al.,“Robust and Discriminative Brain Genome Association Analysis”.
为了解决现有Brain Genome Association (BGA) 研究未考虑类标签而导致BGA研究不具有判别能力的缺陷,Zhu等人[25]提出 BGA分析模型。该模型利用类标签,同时还考虑了数据源间的异质性和数据样本的噪音等问题进行BGA分析。采用十折交叉交叉验证,该文所述方法的分类精度超过最好对比算法3.6%,并远优于baseline方法(图30)。
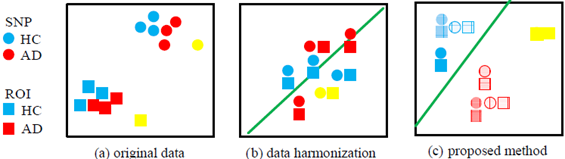
图30:不同方法在原始数据 (a) 上进行Data Harmonization的区别。由于本文方法 (c) 考虑了类标签、样本重要性和数据源重要性等信息,其输出分类超平面性能和去噪方面均比现有方法(b)有明显的优势。图中SNP和ROI分别为Single Nucleotide Polymorphisms和Region-of-Interest的简写,蓝色,红色和黄色分别代表Healthy Control (HC), Alzheimer's Disease (AD) 和Outlier, 绿色直线代表分类超平面。
人脑微结构
26. Huynh et al.,“Probing Brain Micro-Architecture by Orientation Distribution Invariant Identification of Diffusion Compartments”.
弥散磁共振成像能够用于映射人脑组织的微结构变化,但人脑微结构组织之间通常具有较大的变异性。Huynh等人[26]提出了一种球面平均信号谱成像技术 (Spherical Mean Spectrum Imaging, SMSI),用于定量微结构变化。该方法不依赖于固定的组织成分数量假设,而是将扩散信号表示为从粗到细的多尺度光谱扩散过程。该方法允许定量神经轴突密度,微观扩散各向异性,轴突间自由扩散系数等多种组织变化。利用婴儿脑连接组计划 (Baby Connectome Project),验证了该方法即快速又准确,并且能够克服最先进的微结构模型中的偏差; 同时揭示了婴儿出生后两年内大脑微观结构的变化(如图31所示)。
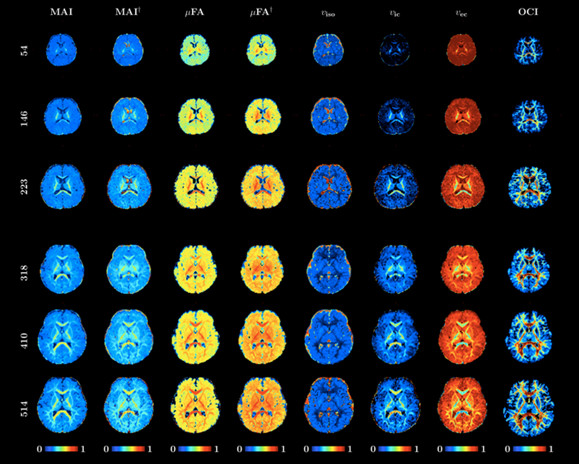
图31:纵向SMSI微结构映射结果。图中展示了某受试者的组织微结构在出生后的54,146和223天里的变化。同时也展示了另一受试者在出生后的318,410和514天里的变化。
27. Huynh et al., “Characterizing Non-Gaussian Diffusion in Heterogeneously Oriented Tissue Microenvironments”.
在人脑中,复杂的各类组织细胞及其细胞膜等微结构组织使得水分子的扩散运动偏离典型的高斯分布。尽管扩散峰度成像 (Diffusion Kurtosis Imaging, DKI) 能够量化这种非高斯形态,但往往被复杂的白质纤维结构所混淆,例如纤维分叉、弯曲和分支等。Huynh等人[27]提出了一种新的扩散峰度成像模型,允许在非均匀方向的微结构环境中表征微结构的非高斯形态。该方法给予一个更广义的结果,即球面平均信号不依赖于体素内的纤维方向分布,因此可以将扩散信号的平均值拟合到对称的峰度模型中,避免了复杂的白质纤维结构对模型本身的影响。实验证明了在有方向异质性的大脑组织结构中,相比于目前的DKI技术,该文所提出的方法在定量微结构的非高斯形态中具有更高的一致性(图32)。

图32:扩散参数映射结果。顶部为扩散峰度成像,底部为本文所提出的微观扩散峰度成像。
参考文献
[17] “Inter-modality Dependence Induced Data Recovery for MCI Conversion Prediction”, MICCAI 2019, Shenzhen, China, Oct 13-17, 2019. [Tao Zhou, Kimhan Thung, Yu Zhang, Huazhu Fu, Jianbing Shen, Dinggang Shen, Ling Shao]
[18] “End-to-End Dementia Status Prediction from Brain MRI using Multi-Task Weakly-Supervised Attention Network”, MICCAI 2019, Shenzhen, China, Oct 13-17, 2019. [Chunfeng Lian, Mingxia Liu*, Li Wang, Dinggang Shen*] * Co-corresponding authors
[19] “Dynamic Routing Capsule Networks for Mild Cognitive Impairment Diagnosis”, MICCAI 2019, Shenzhen, China, Oct 13-17, 2019. [Zhicheng Jiao, Pu Huang, Tae-Eui Kam, Li-Ming Hsu, Ye Wu, Han Zhang*, and Dinggang Shen*] * Co-corresponding authors
[20] “Deep Multi-modal Latent Representation Learning for Automated Dementia Diagnosis”, MICCAI 2019, Shenzhen, China, Oct 13-17, 2019. [Tao Zhou, Mingxia Liu, Huazhu Fu, Jun Wang, Jianbing Shen, Ling Shao, Dinggang Shen]
[21] “Identification of Abnormal Circuit Dynamics in Major Depressive Disorder via Multiscale Neural Modeling of Resting-state fMRI”, MICCAI 2019, Shenzhen, China, Oct 13-17, 2019. [Guoshi Li, Yujie Liu, Yanting Zheng, Ye Wu, Pew-Thian Yap, Shijun Qiu, Han Zhang*, and Dinggang Shen*] * Co-corresponding authors
[22] “MeshSNet: Deep Multi-Scale Mesh Feature Learning for End-to-End Tooth Labeling on 3D Dental Surfaces”, MICCAI 2019, Shenzhen, China, Oct 13-17, 2019. [Chunfeng Lian, Li Wang*, Tai-Hsien Wu, Mingxia Liu*, Francisca Durán, Ching-Chang Ko, Dinggang Shen*] * Co-corresponding authors
[23] “Estimating Reference Bony Shape Model for Personalized Surgical Reconstruction of Posttraumatic Facial Defects”, MICCAI 2019, Shenzhen, China, Oct 13-17, 2019. [Deqiang Xiao, Li Wang, Hannah Deng, Kim-Han Thung, Jihua Zhu, Peng Yuan, Yriu L. Rodrigues, Leonel Perez, Jr., Christopher E. Crecelius, Jaime Gateno, Tiansku Kuang, Steve G.F. Shen, Daeseung Kim, David M. Alfi, Pew-Thian Yap, James J. Xia*, Dinggang Shen*] * Co-corresponding authors
[24] “Pre-operative Overall Survival Time Prediction for Glioblastoma Patients Using Deep Learning on Both Imaging Phenotype and Genotype”, MICCAI 2019, Shenzhen, China, Oct 13-17, 2019. [Zhenyu Tang, Yuyun Xu, Zhicheng Jiao, Junfeng Lu, Lei Jin, Abudumijiti Aibaidula, Jinsong Wu, Qian Wang, Han Zhang*, and Dinggang Shen*] * Co-corresponding authors
[25] “Robust and Discriminative Brain Genome Association Analysis”, MICCAI 2019, Shenzhen, China, Oct 13-17, 2019. [Xiaofeng Zhu, Dinggang Shen]
[26] “Probing Brain Micro-Architecture by Orientation Distribution Invariant Identification of Diffusion Compartments”, MICCAI 2019, Shenzhen, China, Oct 13-17, 2019. [Khoi Huynh, Tiantian Xu, Ye Wu, Geng Chen, Kim-Han Thung, Haiyong Wu, Weili Lin, Dinggang Shen, and Pew-Thian Yap, and the UNC/UMN Baby Connectome Project Consortium]
[27] “Characterizing Non-Gaussian Diffusion in Heterogeneously Oriented Tissue Microenvironments”, MICCAI 2019, Shenzhen, China, Oct 13-17, 2019. [Khoi Huynh, Tiantian Xu, Ye Wu, Kim-Han Thung, Geng Chen, Weili Lin, Dinggang Shen, and Pew-Thian Yap]